Martes 1º de diciembre de 2020, p. 16
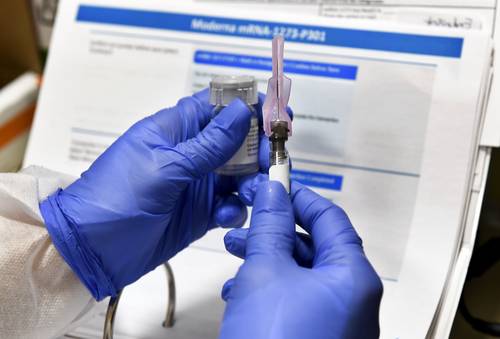
Washington. La biotecnológica estadunidense Moderna Inc, que asegura que su vacuna contra el nuevo coronavirus tiene un éxito de 100 por ciento en la prevención de casos graves, pidió ayer la autorización de uso de emergencia en Estados Unidos y en la Unión Europea.
Las vacunas de Pfizer Inc y Moderna, que utilizan la nueva tecnología de ARN mensajero, podrían empezar a ser administradas a la gente en Estados Unidos antes de Navidad, aseguró el secretario de Salud, Alex Azar.
El biológico de Pfizer Inc. podría autorizarse y enviarse en los días siguientes a una reunión que se efectuará el 10 de diciembre entre asesores externos de la FDA, encargada de revisar los datos de las pruebas y recomendar si se justifica su aprobación.
La vacuna de Moderna podría seguirle una semana después, tras una revisión de la FDA el 17 de diciembre. La farmacéutica también pidió ayer el uso condicional de su fármaco a la Agencia Europea de Medicamentos (EMA).
Dos semanas después de haber anunciado una eficacia de 94.5 por ciento sobre la base de resultados preliminares, Moderna reportó que 196 de 30 mil participantes en su ensayo clínico se infectaron con Covid-19, 185 pertenecían al grupo placebo y 11 al grupo vacunado, con una eficacia calculada de 94.1 por ciento.
¿Y los efectos secundarios?
Ninguna forma grave de la enfermedad se registró en el grupo vacunado, contra 30 en el grupo placebo. La compañía informó que no se observaron nuevos efectos secundarios graves en los voluntarios inoculados, pero no señaló explícitamente si se observaron inicialmente efectos secundarios graves.
“Creemos que nuestra vacuna proporcionará una nueva y poderosa herramienta que podría cambiar el curso de esta pandemia y ayudar a prevenir enfermedades graves, hospitalizaciones y muertes”, declaró el director ejecutivo de Moderna, Stephane Bancel.
En general, el medicamento fue bien tolerado sin importar la edad, el género y la etnia, mientras los efectos secundarios más comunes fueron dolor alrededor del lugar de la inyección, fatiga, rigidez muscular o dolor de cabeza. Un participante del ensayo clínico murió, pero estaba en el grupo de placebo.
La empresa dijo que esperaba tener aproximadamente 20 millones de dosis de la vacuna, llamada mRNA-1273, disponibles en Estados Unidos para fin de año. En 2021, espera fabricar entre 500 a mil millones de dosis a escala mundial.
El laboratorio Novavax Inc informó que aplazó el comienzo de la última etapa de su ensayo en Estados Unidos de su inyección y espera poder empezar ahora en las próximas semanas.
Desconfianza, el enemigo
Las vacunas contra el Covid-19 serán un éxito si se combaten al mismo tiempo la desinformación y la desconfianza, afirmó el presidente de la Federación Internacional de la Cruz Roja y la Media Luna Roja, Francesco Rocca.
Ninguno de los voluntarios que participaron en las fases 1 y 2 de los estudios clínicos de la inyección rusa Sputnik V, desarrollada por el Centro de Epidemiología y Microbiología Nikolái Gamaleya, se enfermó, informó el Instituto de Trasplantes y Biotecnologías.
Rusia distribuyó la primera entrega de Sputnik V para uso civil en un hospital al sur de Moscú, al tiempo que planea comenzar las pruebas masivas de su segunda vacuna contra el virus, EpiVacCorona.
United Airlines trasladó vía aérea el primer envío masivo de la vacuna de Pfizer a Chicago, mientras American Airlines comenzó vuelos de prueba desde Miami a Sudamérica a mediados de noviembre para prepararse para su participación en el transporte del biológico.
Los vuelos promueven las condiciones necesarias para poner a prueba el empaquetado térmico y el proceso de manera operacional, indicó American Airlines.